Микробиота
Колонизация желудочно-кишечного тракта микроорганизмами начинается в течение нескольких часов после рождения и заканчивается в возрасте трех-четырех лет. Характер микробиоты толстой кишки определяется несколькими факторами, такими как грудное вскармливание, географическое положение, генетика, возраст и пол.
Основные функции микробиоты кишечника:
- Расщепление пищевых волокон.
- Синтез пищеварительных ферментов.
- Усвояемость кальция, железа и витамина Д.
- Формирование колонизационной резистентности кишечника.
- Иммуномодуляция.
- Детоксикация.
- Синтез витаминов группы К и В, аминокислот, КЦЖК и др. БАВ.
- Регуляция эндокринной и нервной системы через кишечно-мозговую ось.
- Поддержание кислотно-щелочного баланса.
Основные факторы, повреждающие микробиоту кишечника
- Применение антибиотиков.
- Остаточные пестициды.
- Особенности питания.
В 20 веке произошли драматичные изменения экологии человека (использование систем очистки воды, увеличение частоты кесарева сечения, сокращение грудного вскармливания и широкое применение антибиотиков, особенно у детей. Существует теория «исчезающей микробиоты», согласно которой, важную роль в развитии аллергических и метаболических (ожирение и др.) заболеваний играет не уменьшение поступления микроорганизмов с пищей, водой или из почвы (как предполагает теория «гигиены»), а исчезновение «первобытных» микроорганизмов.

Показателен пример с Helicobacter Pylori, колонизация H.Pylori принимает участие в регуляции секреции гормонов желудка. Эрадикация H.Pylori приводит к увеличению циркулирующих уровней грелина. Нельзя исключить, что исчезновение H.pylori может вносить вклад в эпидемию ожирения у детей, сахарного диабета 2 типа и метаболического синдрома.
Влияние пищи (макронутриентов) на состав микробиоты кишечника вызывает все больший интерес. Было показано, что диетические модели, состоящие из нерафинированных продуктов способны поддерживать рост специализированных микробов, продуцирующих короткоцепочечные жирные кислоты (КЦЖК (SCFAs) – ацетат, бутират, пропионат): основной источник энергии для клеток толстого кишечника (колоноцитов) человека. С другой стороны, типичная западная диета с высоким содержанием сахара и низким содержанием клетчатки снижает выработку SCFAs, сдвигая метаболизм микробиоты желудочно-кишечного тракта к производству вредных метаболитов, способствуя размножению бактерий, связанных с хроническим воспалением.
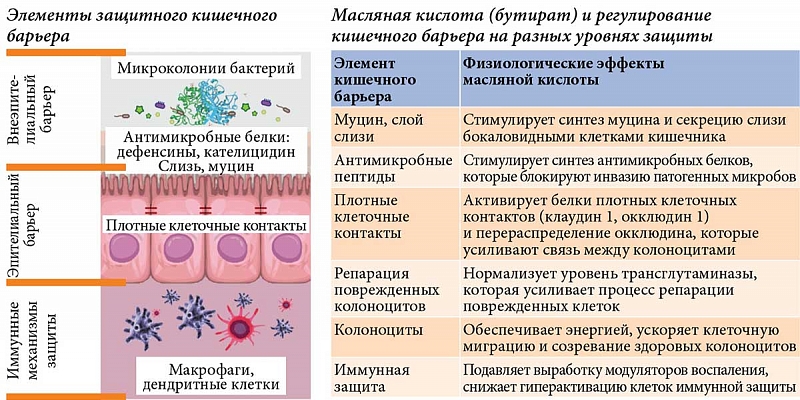
Микробиота кишечника (МК) представляет собой сложную и динамичную экосистему, населенную множеством микроорганизмов, взаимодействующих друг с другом и с человеком-хозяином, включая бактерии, грибы, археи и вирусы. Совокупность генов всех кишечных микроорганизмов представляет собой генетический набор, который на порядок выше, чем у генома человека. В некоторой степени Микробиота считается «основным органом» человеческого тела. Являясь крупнейшей микроэкосистемой в организме человека микробиота находится в симбиозе с хозяином и поддерживает нормальные физиологические процессы в состоянии динамического равновесия. Несмотря на разнообразие видов микроорганизмов (в окружающей среде выделено более 50 семейств бактерий), слизистые оболочки и кожу заселяют только четыре категории: Actinomycetes, Proteus, Firmicutes и Bacteroides (последние два составляют 90%). Соотношение Firmicutes/Bacteroidetes является важным параметром, отражающим состояние микробиоты.
Большое количество исследований предоставило доказательства того, что расстройство микробиоты и нарушение синтеза различных ее метаболитов играют ключевую роль в развитии многих заболеваний, включая нейродегенеративные заболевания, сердечно-сосудистые заболевания, нарушения обмена веществ и желудочно-кишечные заболевания.
Микробиота и депрессия
Сеть нервных сигналов, иммунных сигналов и химических сигналов составляет основную часть оси Мозг-Кишечник-Микробиота. В последние годы все больше исследований показывают, что микробиота кишечника взаимодействует с центральной нервной системой (ЦНС) несколькими путями, что еще больше углубило наше понимание ее влияния на психическое здоровье, включая депрессию. Изменения в этой сети включают сложные взаимодействия между кишечником и нервной системой напрямую, через блуждающий нерв, и опосредованным влиянием через синтез и всасывание различных веществ (системный кровоток). Изменения в составе кишечной микробиоты и, соответственно, образовании короткоцепочных жирных кислот (SCFAs), метаболитов, D-Аминокислот, а также синтезе провоспалительных цитокинов могут изменять нервные сигналы, иммунные сигналы и химические сигналы, вызывая депрессию.
Микробиота и нейродегенеративные заболевания
Взаимосвязь между микробиотой и нейродегенеративными заболеваниями недавно привлекла большое внимание в медицинском сообществе. Все большее число исследований предполагает, что кишечная микробиота может модулировать нервную, эндокринную и иммунную связь через ось кишечник-мозг, которая принимает участие в возникновении и развитии заболеваний центральной нервной системы, особенно при болезни Паркинсона (БП) и болезни Альцгеймера (БА).
Ось кишечник-мозг – двусторонняя связь между кишечной флорой и центральной нервной системой, участвует в регуляции функции мозга, развитии нервной системы и старении.

Существует три основных пути взаимодействия между микробиотой кишечника и осью головного мозга:
- Во-первых, это химические сигналы. Бактерии могут воздействовать на нервную систему прямо или косвенно через SCFAs и другие метаболиты, воздействуя на нейроэндокринную систему, регулируя концентрацию ГАМК и 5-НТ и других нейротрансмиттеров.
- Во-вторых, нервные пути. Флора и их метаболиты могут воздействовать на блуждающую и кишечную нервную систему, влияя на мозг и поведение.
- Последнее – иммунная система. Уровень воспаления, через цитокины оказывают повреждающее действие.
Многие экспериментальные исследования подтвердили наличие оси кишечник-мозг при Болезни Паркинсона. Изменения в микробиоте у пациентов с болезгью Паркинсона могут приводить к накоплению α-синуклеина и избыточной активации микроглии в нейронах головного мозга Недавние исследования показывают, что снижение уровня короткоцепочечных жирных кислот и грелина, опосредованное изменением микробиоты у пациентов с Болезнью Паркинсона, может быть критическим фактором в патофизиологии этого заболевания.
Болезнь Альцгеймера (БА)
Одним из патогенных факторов БА является агрегация белка бета-амилоида в головном мозге с образованием бляшек и повреждением нервов. Сообщается, что микробиота влияет на тяжесть патологии β-амилоидного белка и когнитивные нарушения. Все большее число исследований показало, что БА тесно связана с воспалением, вызванным нарушением состава Микробиоты. Дисбактериоз у пациентов с БА может снижать обилие противовоспалительных бактерий и увеличивать обилие специфических провоспалительных бактерий, включая Escherichia и Shigella. Большое количество метаболитов, продуцируемых провоспалительными кишечными бактериями, может стимулировать инвазию периферических иммунных клеток и повышать уровень воспаления в плазме и центральной нервной системе.
Из вышеизложенного становится ясно, что дисбиоз может способствовать нейровоспалению при прогрессировании болезни Альцгеймера. Регуляция кишечной флоры может стать новой перспективной стратегией в лечении и профилактике заболеваний нервной системы.
Кишечная Микробиота и сердечно-сосудистые заболевания
Гипертония
У пациентов с гипертонической болезнью микробное разнообразие значительно снижено, в то время как отношение Firmicutes / Bacteroidetes значительно увеличено. Изменение кишечной флоры играет ключевую роль в регуляции артериального давления, а изменение продукции кишечных микробных метаболитов может быть ключевым механизмом.

Метаболиты микробиоты могут всасываться в кровь и транспортироваться через гематоэнцефалический барьер для регулирования функции мозга. Дисбаланс короткоцепочечных жирных кислот (SCFAs), вызванный дисбактериозом, может стимулировать хромаффинные клетки кишечника к выработке 5-гидрокситриптамина (5-HT), который может действовать на рецептор 5-HT3 блуждающего нерва кишечника и ингибировать афферентную активность блуждающего нерва от кишечника до мозга. Высвобождение 5-НТ в кровь может привести к сужению сосудов. Кроме того, сероводород (H2S), производимый кишечными микроорганизмами, оказывает серьезное влияние на здоровье человека. H2S может регулировать различные физиологические процессы, включая вазорелаксацию, ангиогенез и гипотензию. Дефицит H2S возникает до возникновения гипертонии. H2S может предотвращать гипертонию с помощью различных механизмов, включая ингибирование окислительного стресса или воспаления и, опосредованное ионными каналами, расслабление гладкой мускулатуры сосудов.
Рандомизированное контролируемое исследование показало, что диетические вмешательства, богатые полифенолами, могут значительно улучшить проницаемость кишечника у пожилых людей, увеличить количество бактерий, производящих целлюлозу и бутират, в кишечной флоре и снизить артериальное давление.
Атеросклероз
Недавние исследования установили возможную связь между кишечной микробиотой и сердечно-сосудистыми заболеваниями (ССЗ) благодаря бактериальной транслокации из кишечника в сердце, а в атеросклеротических бляшках были обнаружены как живые бактерии полости рта, так и бактериальная ДНК, что указывает на то, что микробиота участвует в развитии и прогрессировании атеросклероза. Метагеномное исследование показало, что состав кишечной микробиоты значительно различается у пациентов с атеросклерозом и у здоровых людей. Рост Enterobacteriaceae и Enterobacter aerogenes значительно выше у больных атеросклерозом.
Триметиламиноксид (ТМАО) — еще один метаболит кишечника, играющий важную роль в формировании атеросклероза. Эпидемиологические исследования показали, что ТМАО стал новым индикатором риска сердечно-сосудистых событий. Была указана положительная связь между высоким уровнем ТМАО и заболеваемостью атеросклерозом. Кишечная микробиота метаболизирует холин, бетаин и карнитин с образованием триметиламина, который далее доставляется в печень, где флавинмонооксигеназа превращает его в ТМАО. Высокие уровни ТМАО способствуют миграции макрофагов и ускоряют превращение макрофагов в пенистые клетки, повышая экспрессию провоспалительных цитокинов, тем самым способствуя формированию атеросклероза. ТМАО также ухудшает сосудистую реактивность и вызывает окислительный стресс, что приводит к эндотелиальной дисфункции и атеросклерозу. Кроме того, ТМАО также может активировать тромбоциты, способствуя тромбообразованию и разрыву атеросклеротических бляшек.
Метаболические заболевания
Хотя заболеваемость метаболическими заболеваниями связана с генетическими факторами и факторами окружающей среды, частота метаболических заболеваний у людей с одинаковым генетическим фоном и потреблением энергии коррелирует с наличием определенной кишечной флоры. В последние годы все больше исследований показали, что дисбактериоз тесно связан со многими метаболическими нарушениями, включая ожирение, диабет и неалкогольную жировую болезнь печени (НАЖБП).
Ожирение
Все больше и больше исследований показывают, что микробиота играет важную роль в развитии ожирения. При ожирении превалирует дисбиоз, который проявляется снижением разнообразия и богатства кишечного микробиома. Численность Akkermansia muciniphila, Faecalibacterium prausnitzii и Bacteroides снижается, тогда как численность Phylum Firmicutes значительно увеличивается. Кишечная микробиота обладает способностью ферментировать неперевариваемые углеводы до важных метаболитов, таких как короткоцепочечные жирные кислоты и сукцинат. SCFAs регулируют энергетический баланс и предотвращают ожирение, подавляя аппетит и увеличивая расход энергии. Сукцинат, вырабатываемый кишечными бактериями типа Bacteroidetes, может усиливать глюконеогенез в кишечнике путем связывания с рецептором GPR91 и после этого активировать передачу сигналов из кишечника в головной мозг, что в конечном итоге влияет на ожирение и массу тела.
Сахарный диабет
СД2 — это инсулиннезависимый диабет, который характеризуется снижением секреции инсулина и резистентностью к инсулину. Исследования показали, что по сравнению со здоровыми людьми количество Bifidobacteria и Akkermansia в кишечнике пациентов с СД2 снижено, а количество Dallella увеличено. Эпидемиологические исследования показали, что пациенты с колэктомией имеют повышенный риск развития СД2 по сравнению с пациентами без колэктомии, что косвенно свидетельствует о возможном участии ГМ и секреции гормонов в дистальном отделе кишечника в регуляции метаболизма глюкозы.
Многие исследования показали, что метаболиты микробиоты также участвуют в возникновении и развитии диабета. Метаболиты, такие как липополисахарид, флагеллин, липотейхоевая кислота и пептидогликан, могут разрушать плотные контакты между эпителиальными клетками кишечника и вызывать воспаление посредством сигналов TRL2 и TRL4. Высокий уровень аминокислот с разветвленной цепью и триметиламиноксид (ТМАО) может привести к повышению резистентности к инсулину и воспалению.
Недавно группа китайских ученых совершила прорыв в изучении механизма низкомолекулярных метаболитов, регулирующих уровень глюкозы в крови. Было обнаружено, что гихолевая кислота (HCA) может эффективно регулировать баланс глюкозы в крови и оказывает эффект лечения диабета 2 типа. Активируя TGR5 и ингибируя сигнал FXR, гихолевая кислота способствует выработке и секреции GLP-1 эндокринными клетками кишечника, тем самым контролируя уровень глюкозы в крови. Ожидается, что гихолевая кислота может стать терапевтическим препаратом для лечения диабета, В то же время, поскольку метаболизм холевой кислоты регулируется кишечной флорой, то способы увеличения ее синтеза у пациентов с диабетом с помощью кишечной флоры, также станет предметом будущих исследований и разработки лекарств.
С другой стороны, кишечная микробиота также может автономно регулировать уровень глюкозы в крови через кишечные нервы. Внутренние кишечно-ассоциированные нейроны могут отслеживать сигналы диеты и комменсальных микробов, чтобы регулировать перистальтику кишечника и функции секреции.
Микробиота и желудочно-кишечные заболевания
В ходе длительного эволюционного процесса кишечная флора постоянно адаптируется к индивидуальной адаптации и естественному отбору, а также взаимодействует с хозяином и ограничивает его, чтобы регулировать кишечный гомеостаз. Кишечные микроорганизмы поглощают питательные вещества от хозяина, расщепляют остатки пищи, которые не могут быть переварены хозяином, и участвуют в метаболизме питательных веществ в кишечнике. Накопленные данные свидетельствуют о том, что дисбактериоз может вызывать заболевания пищеварительной системы, включая воспалительные заболевания кишечника и колоректальный рак.
Воспалительные заболевание кишечника
Воспалительные заболевание кишечника – состоящие из язвенного колита и болезни Крона, являются результатом нарушения регуляции иммунной системы, приводящего к воспалению кишечника и микробному дисбактериозу. Потеря кишечного микробного разнообразия как один из признаков дисбактериоза обычно обнаруживается у пациентов с воспалительными заболеваниями кишечника. Кишечная микробиота у них демонстрирует заметное снижение микробного разнообразия, что проявляется в значительном уменьшении Firmicutes при увеличении Enterobacter и Proteobacteria. В дополнение к бактериям в кишечнике увеличивается количество грибов. Разнообразие грибов в толстой кишке, подвздошной кишке и фекалиях пациентов с болезнью Крона значительно увеличивается, что проявляется увеличением Candida albicans, Aspergillus albicans и Cryptococcus neoformans.
Колоректальный рак
Колоректальный рак является одним из наиболее распространенных злокачественных новообразований пищеварительной системы. Кишечный микробный дисбактериоз у пациентов с раком характеризуется уменьшением видов кишечных пробиотиков (таких как Bifidobacteria, Lactobacillus и Bacteroides) и увеличением количества патогенных бактерий (таких как Escherichia coli, Bacteroides fragilis и Fusobacterium nucleatum). Было обнаружено, что количество Peptostreptococcus anaerobius (Pa) значительно повышено в образцах фекалий и опухолевых тканях толстой кишки пациентов с колоректальным раком, что может способствовать аномальной пролиферации клеток толстой кишки. Патогенные бактерии выделяют токсичные химические вещества, которые повреждают эпителиальные клетки кишечника и вызывают хроническую воспалительную реакцию, что способствует развитию колоректального рака.
Заключение
Кишечная микробиота тесно связана со здоровьем и болезнями человека, что открывает большие возможности для диагностики, лечения и профилактики заболеваний. В то же время в исследованиях взаимосвязи кишечных микробов и болезней остается еще много нерешенных загадок. Во-первых, нет единого мнения о том, что такое «хороший» кишечный микробиом. Как определить клинически кишечные микробные расстройства и разработать надежные методы скрининга микробиоты для точной диагностики, чтобы распознать людей с кишечными микробными расстройствами? Во-вторых, до сих пор неясно, является ли кишечное микробное расстройство причиной или следствием заболевания. Кроме того, могут ли кишечные микробы, полезные для лечения заболеваний, предотвращать болезни и способствовать общему иммунному здоровью? Взаимодействие между кишечными микробами, иммунной системой хозяина и заболеваниями не только сложное, но и очень динамичное, это может означать, что на протяжении всего курса лечения заболевания необходимо применять различные методы лечения кишечной микробиоты. В настоящее время существует мало эффективных методов лечения клинических заболеваний путем регуляции кишечной флоры. Воздействие на состав и метаболическую функцию кишечной флоры может стать новым методом профилактики и лечения заболеваний.
Ошибки лечения
Назначение большого количества препаратов, содержащих различные штаммы пробиотиков не всегда является оправданным. В норме содержание бактерий в ЖКТ:
- в желудке может содержаться 10-3 (КОЕ в 1мл) бифидобактерий и лактобактерий;
- в тощей кишке 10-3 – 10-5 (КОЕ в 1 мл);
- в подвздошной кишке 10-5 -10-7 (КОЕ в 1 мл);
- в толстой кишке 10-9 – 10-12 (КОЕ в 1 мл).
В случае излишней колонизации тощей и подвздошной кишки развивается такое заболевание, как СИБР – Синдром Избыточного Бактериального Роста. Причиной может послужить либо поступление микрофлоры из верхних отделов, либо ретроградной транслокации микрофлоры из толстой кишки. Клинически проявляется расстройством стула и нарушением всасывания.
Диагностика:
- Анализ кала на дисбактериоз. Можно увидеть 1. Рост патогенных микроорганизмов (Yersinia, Shigella, Salmonella). 2. Условно-патогенные бактерии (12 категорий), грибы, и их количество. 3. Нормофлора, ее разнообразие и количество.
- Водородно-метановый тест с лактулозой (ВМДТ) – недорогой тест позволяющий с высокой точностью (90%) выявить СИБР.
- Копрограмма. Самый простой и дешевый тест. Один из самых важных показателей, косвенно свидетельствующих о проблемах с микробиотой толстого кишечника это pH. Желательно, чтобы pH был немного сдвинут в кислую сторону.
- Биохимическое исследование метаболической активности кишечной микрофлоры.
В данном исследовании определяется содержание в фекалиях короткоцепочечных жирных кислот – уксусная – С2 (обозначение указывает, что в молекуле кислоты содержится два атома углерода); пропионовая – С3; масляная – С4; изомасляная – iС4 (изомеры характеризуются одинаковым атомным составом, но различаются пространственной структурой и, как следствие, некоторыми физическими и химическими свойствами); изовалериановая – iC5; изокапроновая – iC6.
А также расчетные показатели:- изоCn/Cn – отношение суммарного содержания кислот с разветвленной цепью (изомеров) к кислотам с неразветвленной цепью;
- АИ – анаэробный индекс – отношение суммы пропионовой и масляной кислот к уксусной кислоте.
- Исследование кала на трансферрин и гемоглобин – высокоточный анализ на скрытую кровь.
- Исследование кала на простейшие и яйца гельминтов методом обогащения (PARASEP).
Лечение
- Применение процедур кишечного лаважа – SPA-эфференс.
- Применение препаратов, которые делятся на следующие группы:
- Пробиотики – живые микроорганизмы.
- Пребиотики – не всасывающиеся в тонком кишечнике вещества (клетчатка), олигофруктоза, инулин, арабиногалактан.
- Метабиотики – комплекс структурных компонентов пробиотических микроорганизмов или сигнальных молекул с определенной структурой.
- Синбиотик – комбинация пробиотиков и пребиотиков.
- Постбиотик – инактивированные клетки микроорганизмов и их компоненты.
- Аутопробиотик – полезные бактерии, полученные от конкретного человека, на 100% приживается (степень адгезии очень высокая).
- Взятие образца микробиоты.
- Анализ биоматериала.
- Отбор аутоштаммов.
- Создание аутопробиотика.
- Хранение аутоштаммов в биобанке.
Все жидкие Пробиотики в отличии от сухих, являются по сути Синбиотиками, поскольку содержат как бактерии, так и их метаболиты.
Лучшие синбиотики, по-нашему мнению: Нормофлорин, Хомоспорин, БиоЛонгЛайф.
Лучшие пре/метабиотики: Хилак, Лактис, Актофлор-С.
